Stereochemistry: The Conversion Isomerie Case
of the Monofluoroendecachlorocyclohexanes: C6FCl11 Isomers
by
Prof Dr Dr
Central
Santa Maria, Rio Grande do Sul, Brazil
Chemical
Institute of
In the recently published article, entitled “The significance of Proving the Non-existence of Heptachloro-1,4-Dioxane from Melting Point 122° C” (1), the author discussed the problem of chair configurations in a conversion relationship to one another, separated in substance: cases of isomerism of chair configuration pairs whose partners are present as crystals. Here you will find more details about the isomerism of C6FCl11 formulated in Fig 1.
-Editor
Only after many years of effort, starting 1948 (2), the author succeded in experimentally proving such an isomerism (Fig.1) by isolating two monofluoroendecachlorocyclohexane isomers C6FCl11 (3, 4). Spacial structure of them proved jointly with Prof Y Morino of Tokyo University (7), and in the beginning with Prof W Plieth, FU Berlin (6): Results presented for the first time in a lecture given on 15 May 1986 in Inst of Chem, Saitama University of Urawa, Japan (chair: Prof J Shiomozawa) and some days later also in Inst of Chem, Tokyo University (chair: Prof Y Morino).
Our search for a second heptachloro-1,4-dioxane isomer from 1947 until 1986 was unsuccessful (1), as one of other conversions isomerism cases of chairs configurations. Under high fluorinated cyclohexanes and cyclohexenes like C6HF11, C6HCl9, C6HF9 (8, 11) and the corresponding chlorinated ones: C6HCl11, C6HCl9 we also looked for such an isomerie case in 1954 - but unfortunately without success (10,16).
Fig 1: Monofluorendekachlorocyclohexanes
In chair configurations1)
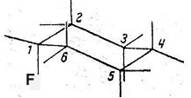
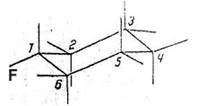
1a(F)1e2ea3ea4ea5ea6ea(Cl) 1e(F)1a2ae3ae4ae5ae6ae(Cl)
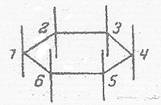
1(F)1.2.2.3.3.4.4.5.5.6.6 (Cl)
simplified level
1) Cl-atoms not drawn in. Explanation of nomenclature in (13a,b)
To reach the aim regarding the two theoretically possible C6FCl11
isomers, from 1948 on we started lots of long time chlorination experiments using a great number of different F-containing starting compounds, summarized in table 1 and 2. The subject here were the chlorination of many C6-ring compounds with at least 1 F-atom (tabl.1) and the fluorination experiments of suitable Br and J containing C6-ring compounds: tabl 2 (4). With more than 40 Hal-substituted C6-ring starting materials (tabl 2) fluorination experiments were carried out to change l Hal for 1 F. The received reaction products where F could be introduced into were further subjected to following long time chlorination experiments with the aim to produce two C6FCl11 isomeres (14, 16-18). The first report about the C6FCl11 mp 315° C was given in 1955 (3), and about the second in 1984 (4b,d).
The existence of two isolated conversion partners of C6FCl11 proves the not even ring structure of cycohexan substation products without application of any physical-chemical method.
Only in Brasil, at the Federal Univeresity of Santa Maria, in Santa Maria-Camobi, RS, we could take the opportunity to set out to sunshine more than 800 filled special DURAN glas tubes from Jenaer Glas for a long time, i.e. even until two years. We lost up to 200 glas tubes that exploded when still lying and also many during opening them under well trained protection features.
Table 1:
F-containing C6-ring-starting compounds for long time chlorinations
Fluorbenzol, p-Bromfluorbenzol, o-, m-, p-Difluorbenzol, p-Jodfluorbenzol,
Monofluorcyclohexan, 1,2,4-Trichlor-4-fluor-benzol vom Schmp. 72°C
Öle, aus denen Trichlormonofluor-cyclohexan abgetrennt worden ist
Pentachlormonofluorbenzol vom Schmp. 140 -141°C,
1,1,2,3,4,5,6-Heptachlor-4-fluor-cyclohexan vom Schmp. 218°C und Öle, aus denen 1,1I2,3,4,5,6-Heptachlor-4-fluor-cyclohexan abgetrennt worden ist,
“Hexachlormonofluorcyclohexan“-Öle und höherfluorierte Verbb. (Heptaöle),
Enneachlormonofluorcyclohexen vom Schmp. 104°C,
1,2,3,4,5,6-Hexachlor-1,2,4,5-tetrafluorcyclohexan vom Fp 79 – 81°C
1,2,4-Trifluor-benzol, 1,3,5-Trifluor-benzol vom Sdp. 74 – 76°C,
1,2,4,5-Tetrafluor-benzol vom Sdp. 87 – 88°C, 1-Chlor-1,4-difluor-benzol Fp 22°C
2,5-Dichlor-1,4-difluor-benzol vom Schmp. 45 – 47°C,
2,6-Dichlor-1,4-difluor-benzol vom Sdp. 59 – 62°C (14 Torr).
Table 2:
Hal-substituted C6-ring- starting compounds, which are subjected to flourination and partially following long time chlorinations (if introduction of F had been successful)[1]
1,2,4,5-Tetrachlor-cyclohexan, C6H8Cl4, vom Schmp. 174°C
1,2,4,5-Tetrabrom-cyclohexan, C6H8Br4, vom Schmp. 185°C
1,2-Dibrom-4,5-dichlor-cyclohexan, C6H8Br2Cl2, vom Schmp. 173°C
α-1-Monobrom-2,4,5-trichlor-cyclohexan, C6H8BrCl3, vom Schmp. 173°C
β-1-Monobrom-2,4,5-trichlor-cyclohexan, C6H8BrCl3, vom Schmp. 223°C
1-Monojod-2,4,5-trichlor-cyclohexan, C6H8Cl3J, vom Schmp. 130°C
1-Monojod-2,3,4,5,6-pentachlor-cyclohexan, C6H6Cl5J, vom Schmp. 120°C
1-Monojod-2,3,4,5,6-pentachlor-cyclohexan, C6H6Cl5J, vom Schmp. 132°C
α-1,2-Dibrom-3,4,5,6-tetrachlor-cyclohexan, C6H6Br2Cl4, vom Schmp. 166°C
β-1,2-Dibrom-3,4,5,6-tetrachlor-cyclohexan, C6H6Br2Cl4, vom Schmp. 285°C
γ-1,2-Dibrom-3,4,5,6-tetrachlor-cyclohexan, C6H6Br2Cl4, vom Schmp. 123°C
α-1,2,3,4-Tetrabrom-5,6-dichlor-cyclohexan, C6H8Br4Cl2, vom Schmp. 203°C
zwei 1,2,3,4,5,6-Hexabrom-cyclohexan-lsomere, C6H8Br6
fünf 1,2,3,4,5,6-Hexachlor-cyclohexan-lsomere : α, β, γ, δ, ε
β-1-Brom-1,2,3,4,5,6-heptachlor-cyclohexan C6H4BrCl7, vom Schmp. 260°C
α-1,1,2,3,4,4,5,6-Oktachlor-cyclohexan, C6H4Cl8, vom Schmp. 93°C
β-1,1,2,3,4,4,5,6-Oktachlor-cyclohexan, C6H4Cl8, vom Schmp. 260°C
Enneachlorcyclohexan, C6H3Cl9, vom Schmp. 95°C
Enneachlorcyclohexen, C6HCl9, vom Schmp. 85 – 86°C
Dekachlorcyclohexen, C6Cl10, vom Schmp. 95 – 96°C
Dodekachlorcyclohexan, C6Cl12, vom Schmp. 285°C
Important data about the first isolated C6FCl11 isomer were
given in a lecture in 1955 (3a); cf also tabl.3: Chlorinations of C6H4FCl7 oils and ref.(3b). - We succeded to isolate the long time searched for second isomer in the beginning of the 80ies (4b,d); see tabl. 4: Further chlorinations of heptaoils with liquid chlorine in sealed tubes under sunlight (received from fluorobenzene-chlorinations).
Tabelle 3:
Example of some chlorinations of C6H4FCl7 mp. 217°C*)
|
Vers. Nr. |
Menge C6H4FCl7 |
Art der Cl2-Einwirkung |
Chloriergs- dauer |
Ausbeute roh |
C6FCl9 95° - 97°C |
C6FCl11 315° C |
|
14a |
5 g |
Gasförmig Cl2 In Lösung |
7 Tage |
5 g |
- |
- |
|
14b |
9 g (5 Rohre) |
fl. Cl2 in Rohren, 10facher Überschuß |
3 Tage |
10 g |
0,4 g |
- |
|
14d |
5 g |
wie 14b |
33 Wochen |
7 g |
1,5 g |
0,8 g |
|
14e |
2 g |
Wie 14b |
55 Wochen |
2,1 g |
- |
0,9 g |
|
14f |
6 g (8 Rohre) |
Nur 5facher Cl2- Überschuß |
55 Wochen |
7,5 g |
2,1 g |
2,3 g |
*) cf also Table 2
Tabelle 4:
Example of chlorinations of heptaoils: C6H5FCl6-oils*) (Table 1)
|
Vers. Nr. |
Menge „C6H5FCl6-Öle“ |
Art der Cl2-Einwirkung |
Chlorierungs- dauer |
Ausbeute roh |
C6FCl9**) 104 ° C |
C6FCl11 315° C* |
C6FCl11 305° C* |
|
20a |
5 g |
fl-Cl2 in Rohren, 10facher Cl2-Überschuß |
33 Wochen |
7 g |
1,5 g |
- |
- |
|
20b |
10g |
wie 20a |
55 Wochen |
14 g |
5 g |
3 g |
0,03 g |
*) Insgesamt sind unter variierten Bedingungen mehr als 200 Reihenversuche durchgeführt worden.
**) Vom C6FCl9 sind zwei Isomere erhalten worden, je nachdem, ob die C6H5FCl6-Öle oder C6H4FCl7 vom Schmp. 217° der Weiterchlorierung unterworfen worden sind: Tafel 2 - Im Falle der C6FCl9-Isomeren dürfte es sich um Stellungsisomerie handeln: Tafel 3
Supposition for the preparation of the examples described in table 3 and 4 were preceeding intensive studies of fluorobenzene chlorinations [Pl 2 (3b,4a,12)] and of monofluoropentachloro-benzene chlorinations (tabl.6 in exp.part).
We collected experiences 1953-55 in long time chlorinations of C6HCl5and C6Cl6 (tabl.5); neglecting the preliminary investigations of the 40ies (9): Addition of chlorine on benzene derivatives in the frame of experiments about “constitution and effect of Cl-based insecticides” . More details about the isolation of C6Cl12, C6HCl9 in tabl.5 (10).
EXPERIMENTAL PART[2])
I Description and characterisation of the monofluoroendecachlorocyclohexane isomeres.
Melting point determination (Eutektika):
Schmelzpunkte der C6FCl11-Isomeren (und der Chlorverbindung C6Cl12) sind unter normalen Bedingungen nicht feststellbar. Erhitzt man den Kofler-Heiztisch langsam, so sind beide Isomeren zwischen 200° und 250° C restlos wegsublimiert. Deshalb haben wir wenige Milligramm der Substanzen in dünnwandige Schmelzpunktsröhrchen eingeschmolzen und den Heiztisch bereits auf 250° C vorgeheizt. Die isolierten C6FCl11-Isomeren schmolzen unter diesen Bedingungen bei 313° bis 315°C bzw. 305°C unter Zersetzung (Chlorabspaltung). C6Cl12 schmolz bei 295° C.
Um die Schmelzpunktsbestimmungen zu vereinfachen, haben wir versucht, eutektische Schmelzen von niederer Temperatur zu bekommen. Für C6FCl11-Isomeren ist uns dies gelungen, während wir mit C6Cl12 keinen Erfolg hatten:
Eutektikum
C6FCl11 (Fp 313°-315° C) + α-C6H8Cl4 (Fp 174° C) 159°-160° C
C6FCl11 (Fp 313°-315° C) + α-C6H8Cl3Br (Fp 173° C) 149° C
C6FCl11 (Fp 313°-315° C) + α-C6H8Cl2Br2 (Fp 173° C) 154° C
C6FCl11 (Fp 304°-305° C) + α-C6H8Cl3Br (Fp 173° C) 139° C
Die Schmelzpunkte wurden nach inniger Durchmischung der Proben in üblicher Weise unter dem Kofler-Mikroskop bestimmt, indem das erste beginnende Schmelzen als eutektischer Punkt genommen wurde.
Zn-dust treatment:
Bei der Zinkstaub-Behandlung der C6FCl11-Isomeren (15) resultieren Gemische aus C6FCl5 und C6Cl6; da diese Gemische schwer trennbar waren, sind vom System C6FCl5 + C6Cl6 Schmelzdiagramme gemacht worden: Tab 7 und Fig. 2. Dieses Diagramm erwies sich auch als nützlich, als wir Chlorierungsprodukte von Fluorbenzol in Gegenwart von Katalysatoren näher untersuchten: Exp. Teil IV.
II Preparation and reactions of high fluorinated cyclohexanes and cyclohexenes; startingmaterial: Perfluordicyclohexyl [Plate 1 (8,11)].
Daß wir so intensiv und unter Einsatz sehr vieler verschiedener Ausgangsstoffe gerade die Herstellung von C6FCl11 bevorzugt untersucht haben, hängt unter anderem mit den negativen Erfahrungen zusammen, die wir mit den entsprechenden hochfluorierten Cyclohexanen: C6F11Br vom Sdp. 88-91°C, C6F11Cl vom Schmp. 25-27°C und C6HF11 vom Schmp. 45-47°C gemacht hatten (8): Nur die zuletzt genannte Verbindung kristallisiert gut.
Vor allem gab es in den genannten drei Fällen kaum Variations-möglichkeiten zur Herstellung und ihrer Ausgangstoffe, um vielleicht dadurch zu den angestrebten stereoisomeren Konversionspartnern zu gelangen.
Die genannten drei hochfluorierten Cyclohexane sind in unsere Betrachtungen miteinbezogen worden, nachdem wir von den Veröffentlichungen von Barbour[3]) und Mitarbeitern Kenntnis bekommen hatten[4]). Die Nacharbeitung der in Tafel 1 zusammen-gefassten Reaktionen ist in Zusammenarbeit mit Prof.Dr.Gg.R.Schultze, Erdölinstitut der TH Hannover erfolgt, wobei uns die Erfahrungen zugute kamen, die wir ab 1943 durch die bei 550-750° C durchgeführten Aromatisierungsversuche mit ungesättigten Kohlenwasserstoffen gesammelt hatten [PROJ III in (5)].
“Tafel 1” in text means here Plate 1, to be found on the following page.
Plate 1:
Preparation and reactions of high fluorinated
cyclohexanes and cyclohexenes – using the prescriptions of Barbour,
Barlow, Tatlow und
Starting material: C12F22 , perfluordicyclohexyl (mp 74-75°C)
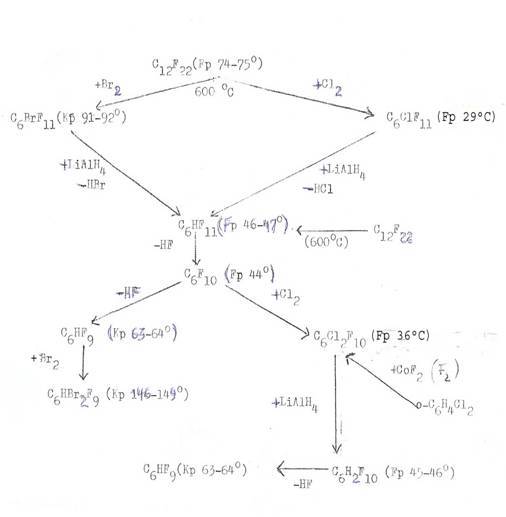
*) ausführliche Protokolle über Beschreibung der Apparaturen, Arbeitsvorschriften und Versuchsdaten in den unter der Leitung von R. Riemschneider und Gg.R. Schultze durchgeführten Examensbeiten von A. Patel, R. A. Faria,TH, Hannover; vgl. (8, 11)
III Long time chlorination of penta- and hexachlorobenzene as well as of monofluoropentachlorobenzene: tab 5 and 6 (10)
Langzeitchlorierung bedeutet hier, Arbeiten in Einschlußrohren, die 52 Wochen und länger auf dem Institutsdach so aufbewahrt worden sind, dass das Sonnenlicht gut heran konnte. Von 500 Rohren sind nach 1 bis 2 Jahren über 200 geplatzt, beim (gefährlichen) Öffnen der Bomben-rohre gingen wiederum ca. 15 % verloren. - Besonders intensiv wurde von uns im Rahmen von Modellversuchen zum Studium von Langzeitchlorierungen die Chlorierung von Pentachlorbenzol vom Schmp. 85°C und Hexachlorbenzol untersucht: Tab 5 (10)[5]
Table 5:
Chlorination of penta- and hexachlorobenzene in sealed tube
|
Lfd. |
C6HCI5 |
C6Cl6 |
Cl2 |
Versuchsdauer |
|
Isoliert 2 |
|
|
|
Nr. |
g |
g
|
ml |
Wochen |
C6Cl6 |
C6HCl9 |
C6Cl10 |
C6Cl12 |
|
1 |
5 |
— |
40 |
0,51 |
+ (5)1 |
|
|
|
|
2 |
5 |
--- |
40 |
1 1 |
+ |
|
|
|
|
3 |
5 |
--- |
50 |
81 |
+ |
+ |
|
|
|
4 |
5 |
--- |
30 |
111,3 |
+ |
|
|
|
|
5 |
7 |
--- |
40 |
131,3 |
+ (5) |
|
+ |
|
|
6 |
10 |
— |
40 |
15 |
+ (8) |
|
+ |
|
|
7 |
5 |
--- |
40 |
341 |
+ |
|
+ |
+ |
|
8 |
5 |
— |
3 |
274 |
+ |
+ |
+ |
|
|
9 |
— |
5 |
2 |
84 |
+ (5)5 |
|
|
|
|
10 |
— |
10 |
40 |
96 |
+ (7)5 |
|
+ (5) |
|
|
11 |
--- |
7 |
40 |
147 |
|
|
+ |
+ |
|
12 |
--- |
5 |
50 |
15 |
+ (4)5 |
|
+ |
|
|
13 |
--- |
5 |
25 |
188 |
+ 5 |
|
+ |
+ |
|
14 |
— |
10 |
40 |
226 |
+ 5 |
|
+ |
|
|
15 |
--- |
10 |
50 |
236 |
+ (7)5 |
|
+ (0,7) |
+ (2) |
|
16 |
— |
5 |
40 |
309 |
|
|
+ (1,5) |
+ (3) |
|
17 |
— |
5 |
50 |
329 |
|
|
+ (0,8) |
+ (3) |
1 Völlig gelöst nach 2 bis 5 Tagen
2 Die in Klammern hinzugefugten Zahlenangaben bedeuten g isolierter Substanz
3 Nach 3 Wochen Kristallabscheidung im Rohr
4 Ungelöst
5 Unverändertes Ausgangsprodukt
6 Zum Teil gelöst
7 Völlig gelöst nach 2 Wochen. Kristallabscheidung nach 7 Wochen
8 Zum Teil gelöst nach 4 Wochen
9 Völlig gelöst im Laufe der Zeit
Key to Tab. 5:
Aus allen Einschlußrohren, in denen C6HCl5 4 bis 20 Wochen mit einem großen Überschuß an flüssigem Chlor behandelt worden war, konnte C6Cl6 als Hauptprodukt isoliert werden. Bei einer Versuchsdauer von 13 bis 30 Wochen entstand aus dem primär gebildeten C6Cl6 Dekachlorcyclohexen, C6CI10 vom Schmp. 96°C bei längeren Versuchszeiten außerdem Dodekachlorcyclohexan, C6Cl12, vom Schmp. 286°C. Bei keinem der insgesamt durchgeführten 45 C6HCl5-Chlorierungsversuche haben wir die Bildung von Endekachlorcyclo-hexan, C6HCl11, beobachten können. Eine Vorstufe von C6HCl11, ein Enneachlor-cyclohexen, C6HCl9, vom Schmp. 85 bis 86°, ließ sich nur aus solchen Chlorierungen abtrennen, bei denen wenig Chlor zur Einwirkung gebracht worden war oder bei denen die Reaktionsdauer weniger als 10 Wochen betrug: Tab. 5, Nr. 8 und 3). C6HCl11-Bildung stellten wir auch in diesem Falle nicht fest. C6HCl9 geht bei der Weiterchlorierung in C6Cl10 und C6Cl12 über. Die Chlorierung von C6HCl5 vom Schmp. 85° führt im wesentlichen zu denselben Chlorierungsprodukten wie die Einwirkung von Chlor auf C6Cl6 (Tab. 5). Die Addition des letzen Mol Chlor an C6CI10 erfolgt außerordentlich schwer, wie aus den langen Versuchszeiten hervorgeht, die zur Bildung von C6Cl12 eingehalten werden müssen. Die Tatsache, dass C6HCl11 bei der Chlorierung von C6HCl5 nicht entsteht, läßt sich, wenn wir von anderen Faktoren absehen, dadurch erklären, dass die Substitution des Wasserstoffes in C6HCl5 bzw. C6HCI5 leichter als die Addition von Chlor erfolgt. Möglicherweise ist C6HCl11 überhaupt nicht existent, da die beiden theoretisch möglichen Sessel-Konfigurationen von C6HCl11: ea, ea, ea, ea, ea,e und ae, ae, ae, ae, ae, a (13a,b) fünf bzw. sechs meta-Stellungen a-gebundener Cl-Atome aufweisen, in den Konfigurationen der bisher isolierten H-haltigen Polychlorcylohexane und -cyclohexene jedoch nur eine, meist aber gar keine meta-a-Lage von Halogenatomen vorkommt.
Table 6:
Chlorinations of monofluoropentachlorobenzene in tube
|
No. |
C6FCl5 |
Cl2 |
Time |
|
isolated |
|
|
|
g |
ml |
weeks |
oils |
C6FCl11 |
|
|
|
|
|
|
|
mp 315 |
mp 305 |
|
1 |
3 |
0,5 |
20 |
+ |
- |
- |
|
2 |
3 |
2,0 |
20 |
+ |
- |
- |
|
3 |
3 |
5,0 |
20 |
+ |
- |
- |
|
4 |
3 |
5,0 |
40 |
+ |
- |
- |
|
5 |
3 |
10,0 |
40 |
+ |
- |
- |
|
6 |
3 |
20.0 |
40 |
+ |
0,2 |
- |
|
7 |
3 |
30,0 |
40 |
+*) |
0,1 |
- |
*) mit 0,1g C6Cl12
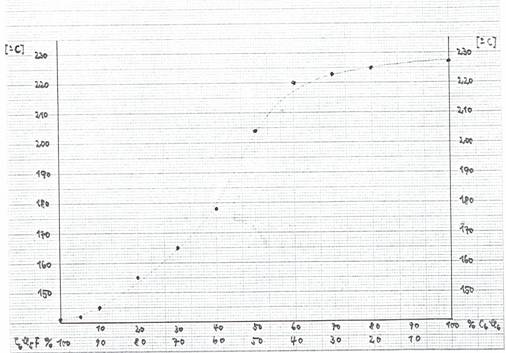
Table 7:
Experimental data to Fig 3: System C6FCl5 + C6Cl6
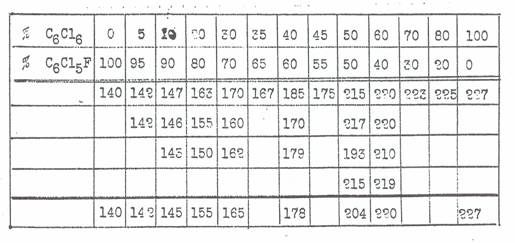
Figure 3:
Diagramm to table 7: System C6FCl5 + C6Cl6
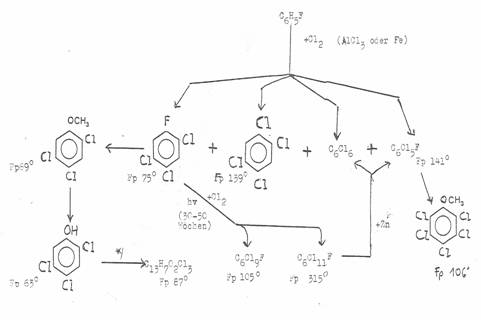
IV Chlorinations of fluorobenzene : Plate 2 - 4
Plate 2: Chlorinations of fluorobenzene and its chlorination products [hv] (3b,12)
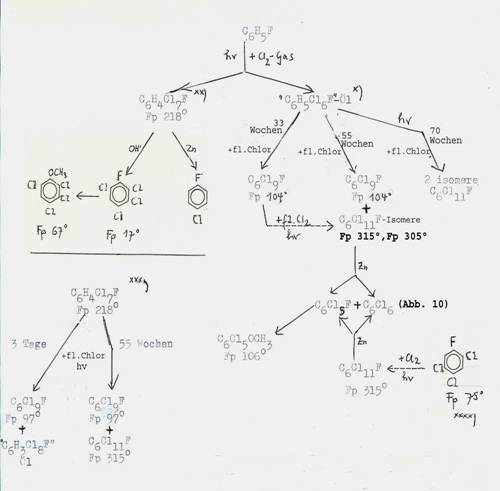
*) aus 10g Öl erhielten wir nach 55 Wochen 14 g Rohprodukt, davon
5g C6FCl9 mp 104° und 3g C6FCl11 mp 315°C und 0,03g C6FCl11 mp 305°C; nach 33 Wochen nur C6FCl9 mp 104°C; vgl. Tabelle 7
**) Konfiguration: [1e2e3e4ea5e6e(Cl)1a(F)]
***) aus 3g C6H4FCl7+ 7,5g fl.Cl2: 1,2g C6FCl11 + 1,0g C6FCl9 mp 97°C.
****) aus Fluorbenzol + Cl2 (Fe), 100°C, neben 1,2,4,5-Tetrachlor-benzol
mp 139°C: Tafel 4.
Key to Plate 2:
Das Ausgangsmaterial, die „C6H5FCl6- -Öle“ entstehen beim Einleiten von Chlor in Fluorbenzol ohne Katalysator- und ohne Lösungsmittel-Zusatz, aber UV-Bestrahlung: Gewichtszunahme von 200g unter Erwärmung (Wasserkühlung), wenn 250ml Fluorbenzol 30 Stunden chloriert wurden. Weitere Chloraufnahme konnte nicht erreicht werden. Aus dem Reaktionsprodukt, einem stark riechenden Öl, schieden sich nach einwöchigem Stehen im Kühlschrank Kristalle ab, die abgesaugt und aus CCl4 umkristallisiert wurden: 85g Rohprodukt, 1-Fluor-1,2,3,4,4,5,6-Heptachlor-cyclohexan vom Schmp. 218°C. Die verbleibenden Öle der Zusammensetzung C6H5FCl6 sind in ca 20 Bombenrohren weiterchloriert worden, z. B. je 5g Öl mit 50g fl. Chlor sind im Rohr 55 Wochen dem Sonnenlicht ausgesetzt worden. Rückstand nach Eliminierung des überschüssigen Chlors: z.B. 14g einer mit zähem Öl vermischten Kristallmasse. Zur Trennung wurden SiO2-Säulen verwendet (50cm hoch, 3cm Durchmesser, fein gepulvertes SiO2 mit wenig Nitromethan behandelt). Die Füllung feuchteten wir jeweils mit mit Nitromethan gesättigtem Petrolether (Kp 30-70°C) an. Zum Auslösen der 14g benötigten wir 70ml kalten Petrolether/Nitromethan. Die Lösung wurde zweimal filtriert und unter Eluieren mit größeren Mengen Lösungsmitteln bei 1 Atü langsam durch die Säule gedrückt (Beispiel).
40 Fraktionen von je 10 ml, aufgearbeitet in Tabelle 7 (Plate 7):
Plate 7: Example
|
Fraktion |
Schmp. °C |
Identifiziert als |
|
1-7 |
kein Rückstand |
|
|
8-10 |
97-103 |
C6FCl9 |
|
11-13 |
105-107 315 |
C6FCl9 C6FCl11 |
|
14-20 |
315 |
C6FCl11 |
|
21-29 |
315 (Spuren) Öl, daraus 305 (2.Isomeres) |
C6FCl11 C6FCl11 |
|
30-40 |
Öl und 105 |
C6FCl9 |
Plate 3: Katalytic chlorination of fluorobenzene (Fe, AlCl3) and followreactions incl. identifications (12)
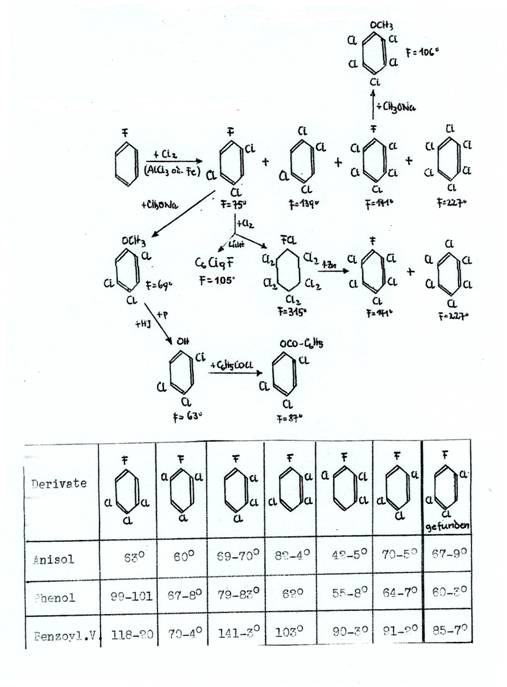
“gefunden” means found.
Plate 4: Fluorobenzene-chlorinations (12, 3b)
*) + Benzoylchlorid
V Dekahalocyclohexenes: C6Cl10, C6FCl9, C6Cl9Br: Fig 2, Pl.5
Zur Herstellung (16):
C6Cl10, erhalten aus C6Cl6 + fl.Cl2 (Tab.5)
C6FCl9-Isomere ,erhalten C6H5F-Chlorierungsprodukten: Tafel 2 Stellungsisomere gemäss Tafel 4 und 3
C6Cl9Br-Isomere, erhalten aus Chlorierungsprodukten von trans-1.2-Cyclohexan: Tafeln 5 und 6 im Expt. Teil VI
Die C6Cl9Br-Isomeren vom Schmp. 105° und 150°C sind aus den sog. „Hexa-Ölen „C6H6Hal6“ durch Einwirkung von fl. Chlor in Einschlußrohren neben C6H4Cl7Br vom Schmp. 268°C (1-Brom- 1,2,3,4,5,6,7-heptachlor-cyclohexan) erhalten worden [Die Hexa-Öle“ wiederum über die Tetra-Öle „C6H8Hal4“*) ausgehend vom trans-1,2-Dibrom-cyclohexan vom Sdp. 101 – 102° (12 Torr)]: Pl 6.
Halogenabspaltung unter Alkalieinfluss:
Es wurde das chemische Verhalten der verschiedenen isolierten
Dekahalocyclohexene C6FCl9 und C6Cl9Br gegenüber 1,5n methanol. KOH (Rückfluß) und gegenüber Zinkstaub geprüft.
Am stabilsten gegenüber Alkali erwiesen sich das C6FCl9-Isomere:
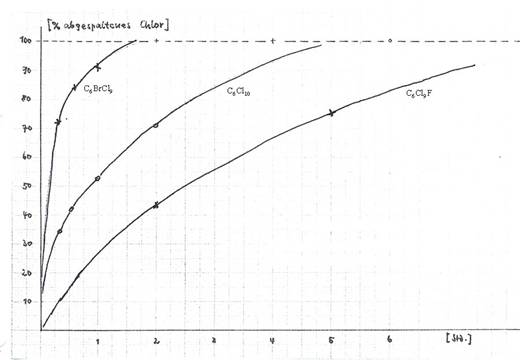
Fig 2: Splitting off Halogen from C6Cl10, C6FCl9 und C6Cl9Br (mp 105° C) in 1,5n methanol. KOH (reflux)
46,5mg C6FCl11 mp 315°C spalteten beim Erhitzen mit 20ml 3n methanol. KOH unter Rückfluß nach 5 Std. 4,5 Cl-Atome ab, titriert mit 0,1n AgNO3 (4,15 ml). Auch bei Anwendung der doppelten KOH-Konzentration konnten nicht 6 Cl abgespalten werden.
Die präparative Alkalibehandlung von C6Cl9Br vom Schmp. 105-107°C führte zu wenige C6Cl6 und einem bei 75-78°C schmelzenden Produkt der Formel C6HCl4Br (nicht weiter bearbeitet).
Zn-dust treatments, preparative and analytical[6]
Treating 2g C6FCl11 mp 315° C with 30g Zn-dust in 250 ml methanol (reflux) 5 hours we received a mixture of C6FCl5 and C6Cl6 mp 155° — 157° C (needles), containing ca. 80% C6FCl5: Figure 3 and Table 7.
Zn-dust treatment of C6Cl10 mp 96° C resulted in a mixture of
C6Cl6 (mp 227° C) and C6HCl5 (mp 86° C).
Zn-dust treatments of C6Cl11Br resulted in C6Cl6 and oils as mainproduct.
The C6Cl11Br isomer mp 105° - 107° C (mixture ?) delivered in preparative Zn-dust experiments small amounts of C6Cl6 and oils, not separated (C6Cl6Br + C6HCl4Br isomers ?) as the main product; cf the following formulae:
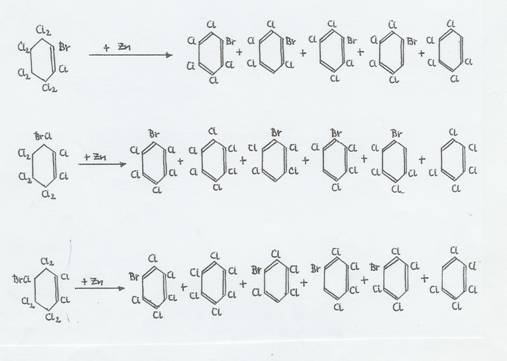
VI Mixed halogenated cyclohexanes and cyclohexenes – prepared starting from trans-1.2-dihalo-cyclohexanes via „tetra-oils and hexa-oils“
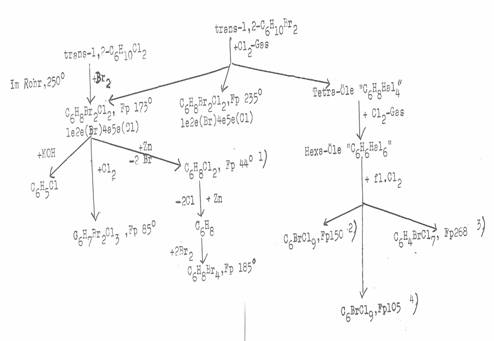
In Tafel 5 und 6 sind in unterschiedlicher Darstellung die Ergebnisse der Halogenierungen von trans-1.2-Dichlor- und trans-1.2-Dibrom-cyclohexan vom Sdp 187°C bis 189°C bzw. 101°C bis 102°C (13 Torr) über 1,2,4,5-Tetra(hetero)halo-cyclohexane bzw. „Tetra-Öle“ und „Hexa-Öle“ [Sdp 150° - 170°C (6 Torr); nD: 1,584 (20°C)] bis zu C6Cl9Br-Isomeren und C6H4Cl7Br zusammengestellt.
Plate 5: Halogations of trans-1,2-dihalo-cyclohexanes to tetra(hetero)halocyclohexanes and follow reactions
(monobrom-enneachlorocyclohexanes)
1) 4,5-Dichlor-cyclohexen-(1)
2) nur einmal isoliert
3) Konfiguration 1e(Br)1a2e3e4ea5e6e(Cl)
4) Hauptprodukt, vgl. auch Tafel 6 (Plate 6)
Theoretisch sind 3 C6Cl9Br-Isomere möglich:
1-Brom-2,3,3,4,4,5,5,6,6-enneachlor-cyclohexen-(1),
3-Brom-1,2,3,4,4,5,5,6,6-enneachlor-cyclohexen-(1),
4-Brom-1,2,3,3,4,5,5,6,6-enneachlor-cyclohexen-(1).
Plate 6:
Halogenations of trans-1,2-dihalo-cyclohexanes to tetra(hetero)halocyclohexanes and follow reactions
(monobrom-enneachlorocyclohexanes) - alternative to Plate 5 (14).
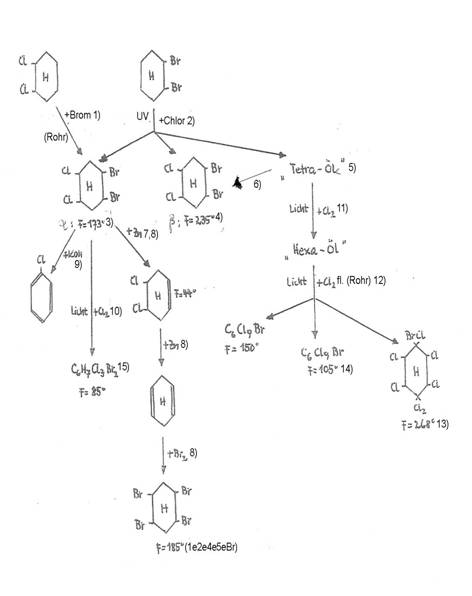
1) Im Einschlussrohr, 8 Std. bei 260°C; 2) offen, Raumtemp.; 3) α-Isomeres der Konfiguration 1e2e(Br)4a5a(Cl); 4) β-Isomeres: 1e2e(Br)4e5e(Cl); 5) Hauptprodukt aus den Chlorierungen von 2); 6) auch aus „Tetra-Ölen“ isoliert; 7) 5-stdg. Zinkstaub-Behandlung in CH3OH (Rückfluß); 8) Tetra vom Schmp. 183°C, nach 10-stdg. Zinkstaub-Behandlung in CH3OH (Rückfluß) und Bromierung; 9) nD: 1,519 (25°C), Lit. 1,512; 10) in CCl4, offen, Raumtemp.; 11) offen, Raumtemp.; 12) in 10 Rohren: umgesetzt je 10g „Hexaöl“ + 3g fl. Chlor im Sonnenlicht, 4 Wochen; 13) identifiziert durch Mischschmelzpunktsbestimmung mit authentischem Präparat; 14) Zinkstaub-Behandlung; 15) 1.2-Dibrom-x.4.5-trichlor-cyclohexan.
VI Physical mesuraments on C6FCl11 isomeres
Dipolmoment
determinations of the C6FCl11
isomere, mp 315° C, were carried out in
1957 in the Biochemical Dept., FU Berlin, experiments on the second isomere, mp 305° C,
in the
The determined values corresponded with the theoretically calculated ones: 0 - 0,3 D.
The
data of X-ray-determinations, started 1955 in co-operation with W.Plieth and
co-workers, finished with Y.Morino and co-workers 1987 (labreports in office of
Prof.Y.Morino,
REFERENCES:
(1) R. Riemschneider
The significance of proving the non-existence of heptachloro-1,4-dioxane from melting point 122oC http://www.bwwsociety.org/journal/html/heptachloro.htm About so-called heptachloro-1,4-dioxane from m p 122oC http://www.bwwsociety.org/journal/html/bcompounds.htm
(2a) R. Riemschneider
Lectures: Exposé on the subjects:
- „Stereoisomeren-Asymmetrie“
- „Stabile hochsubstituierte Cyclohexane, Dioxane - „in Substanz zu trennende Konversionspartner - [Sessel-Modell]“
- „«Achse-Ring»-Molekülaggregate I und II und Synthesewege“ [7]
- „«Sterisch gehinderte» Ether der Benzol-, Naphthalin- und Anthracen-Reihe“
March 1948, 21 p (unpublished),
lectures given Oct and Nov 1948 in small circle at
Eine Veröffentlichung dieser Ausarbeitungen wurde auf Anraten von befreundeten Fachkollegen, vor allem von Prof. Dr. A. Lüttringhaus, zurückgestellt (Vermeidung von Konkurrenz).
(2b) R. Riemschneider
„Über Konversionspartner von hochsubsituierten Cyclohexanen und 1,4-Dioxanen“,
Lecture, given in Nov 1949 at Physiolog.-chem.Inst.,
Universität
Ms, 19 p, (unpublished)
(2c) R. Riemschneider
3-part lecture
- „Sterisch gehinderte Ether
- Stabile Konversionspartner hochsubstituierter Sessel-Konfigurationen
- Achse-Ring-Aggregate - keine feste chemische Bindung zwischen Ring und Achse“,1)
given on 10.8.1955 in Englisch on invitation of Prof. Dr. R. Wasicky, Universität S.Paulo
Ms 1954, 18 p + 8 plates (Slides),
hektographiert nach Übersetzung ins Portugiesische [50 Exemplare], 3 der 8 Tafeln sind in [(5): PROJECT II im Abschnitt II 7] abgebildet; anwesend beim Vortrag waren: Prof. Dr. José Mariano da Rocha Filho, späterer Rektor der brasilianischen Universität Santa Maria (USM, UFSM), Prof. Dr. R. Wasicky als Diskussionsleiter, Prof. Dr. J. Joachimovicz, später USM, UFSM sowie einige Professoren der Organischen Chemie der Universität S.Paulo, SP, Brasilien
(3a) R. Riemschneider
“Erstes C6FCl11 , Fp 315°C, isoliert aus Fluorbenzol-Chlorierungs-produkten: Schmelzpunktsbestimmungen (Eutektikum), Zinkstaub-, Alkali-Behandlung, UV-, IR-, RAMAN-Spektren, Dipolmoment-messungen“
Lecture, given in Dez 1955 at Colloquium “Dozentur für Organische Chemie“ am Institut für Organische Chemie, FU Berlin.
Ms, Dec 1955, 10 p, unpublished
(3b) R.Riemschneider
Chlorination of fluorobenzene (Chlorierung von Fluorbenzol)
Mh Chem 91 2605-2608 (1958)
Description and characterisation of C6FCl11 isomer mp 315°C
(4a) R.Riemschneider, G.Ottmann, E.B.Grabitz, H.J.Hein, E.Becker, U.Rau, J.Jakobi
Long-term chlorination experiments, starting from F-substituted benzenes and cyclohexanes and isolated reaction oils (1955-69) (Langzeitchlorierungen von F-substituierten Benzolen und Cyclohexanen und entstandenen Ölen)
Labreports 1969, 63 p, only extracts published, i.e. (4b); starting materials summarized here in tab 1 and 2.
(4b) R.
Riemschneider, S. Singer, G. Boden, M.M. Faria, M.Z. Azhar
On the second isolated C6FCl11-isomere,
mp 305°C
Labreport May 1984 (secreted); 1984, 5 p, Inst of Biochemistry, FU Berlin and Central Inst of Chemistry, UFSM, S. Maria, RS, Brasil
(4c) R.Riemschneider, W.Pollak, F R Pessserl, M.M.Faria, K.Nolde
Continuation of long-term chlorination experiments to isolate monofluoroendekachlorocyclohexane(s), starting from fluorobenzene, difluorobenzenes, fluorotrichlorobenzene, monofluoropentachlorobenzene, monofluoroheptachlorocyclohexane mp 218°C, from monofluorohexachlorocyclohexane oils and many other fluorine derivatives (1969-1986) (Fortsetzung der Langzeit-chlorierungen zwecks Isolierung von Monofluorendekachlorcyclohexan(en), ausgehend von…) summarized here in tab 1 and 2
Labreports 1969-1985, PROJ II 6 in (5)
Inst of Biochemistry, FU Berlin, and Central Institute of Chemistry, UFSM, S.Maria, RS, Brasil
(4d) R.Riemschneider, M Z Azhar F R Pesserl
„Two isolated Monofluoroendekachlorocyclohexanes, C6FCl11
mp 315°C and 305°C”
Lecture Ia, given in May 1986 in colloquium of Chemical Inst of SAITAMA University at Urawa, Japan (chair: Prof dr J Shimozawa)
Ms 1985 , 12 p (disk)
Lecture 1b,
given in June 1986 in colloquium of Chemical Inst of
(4e) R.Riemschneider, W.Pollak, M Z Azhar
“ Experiments to introduce fluoro in Cl-, Br-, J-containing polyheterocyclohexanes and –cyclohexenes and chlorination of C6-ring compounds, containing 1 F atom” („Versuche zur Einführung von Fluor in Cl-, Br-, J-haltige Poly-heterohalocyclohexane und -cylohexene -Chlorierung von C6-Ring-Ausgangsstoffen, enthaltend ein F-Atom")
Lecture II, given in May 1986 in colloquium of Chemical Inst of SAITAMA University at Urawa, Japan (chair: Prof. dr J Shimozawa)
Mss 1985 , 45 p (disc)
- Fluorination of 21 polyheterocyclophexanes and following long-term chlorinations of F-containing reaction products
- Chlorination of C6-ring compounds, containing 1 F-atom and chlorination oily reaction products received after separation of their cristallized parts
Experiments carried out from 1955-1986 in Chemical Central Istitute of UFSM, S.Maria, RS, Brasil and some analytical parts in Inst of Biochemistry FU Berlin
(5) R Riemschneider
Re-reading - 66 years of chemistry (Nachlese, 66 Jahre Chemie) in preparation
PROJECT I - XXVI
(6) R. Riemschneider, W. Plieth
Experiments to determine the spatial structure of C6FCI11 mp. 315°C by X-ray-analysis, carried out at
the Institut für Physikalische Chemie der FU
Record of these
experiments from Januar 1973, are uncomplete, because co-worker got very ill
and could not finish. Continuation of the work after isolation of the second C6FCI11-Isomere
in
(7) Y. Morino, R. Riemschneider, M.Z. Azhar
Strukture determination of the two isolated monofluorendekachlor- cyclohexane-isomeres by X-ray-analysis,
Report 1986, 9 p (disc), from the Chemical Institute of Tokyo University and from
the
The records from 1973 (7) on the Isomere melting at 315°C were also taken into consideration here.
(8) R. Riemschneider (Vortragender), A. Heymons, Gg.R. Schultze, K. Schulze
„Über hochfluorierte Cyclohexane und Cyclohexene“
Lecture given on 15.7.1954 in form of round-table-talks at Firma RIEDEL DE HAEN, Berlin-Britz; cf (11).
Ms and labreports, July 1953-54, 22 p. Experimental data in plate 1 (here) and in (5) there Spezial Part IX 3.6.
Herr Dr. K. Schulze, Abteilung Biologie der genannten Firma, hat sämtliche in Tafel 1 genannten Cyclohexan- Substitutionsprodukte aus rein akademischem Interesse auf insektizide Wirkung geprüft. Sämtliche hoch-halogenierten Verbindungen erwiesen sich als unwirksam gegenüber Bombyx mori (Seidenraupen).
Entsprechendes gilt auch für die in den Jahren 1961 bis 1964 und später (12, 4c) hergestellten Fluorbenzol-Chlorierungsprodukte aus Tafel 2-4.
Diese mit den nur Maulbeerbaumblätter fressenden Seidenraupen gemachten Erfahrungen kamen uns später bei Untersuchungen mit Schmetterlings-lockstoffen zugute: (5) PROJ VIII 3,10.
(9) R. Riemschneider
„Zur Kenntnis der Kontaktinsektizide II, 9. Beih., 1. Erg. Bd zur Pharmazie“, 1949, pp. 731-736
(10) R. Riemschneider und R. Oswald
Chlorierung von Penta- und Hexachlorbenzol,
Mh. Chem. 85, 972-975 (1954); cf (9)
(11) R. Riemschneider, Gg. R. Schultze, A. Patel und R. A. Faria
Über hochfluorierte Cyclohexane und Cyclohexene
Ms 1954, 12 p, unpublished; cf (8).
(12) R. Riemschneider, S. Singer
Chlorierungen von Fluorbenzol,
1,3,4-Trichlor-2-fluor-benzol etc [Mitt. LVII e]
Labreport January 1964, 8 p: here Plate 2 - 4.
(13a) R. Riemschneider
Über „vereinfacht eben“ und „Sessel-Konfiguration“ von Cyclohexan-Substitutionsprodukten,
Z. Naturforschg. 10 b, 605 – 613 (1955); copy in PROJ IX 4,1 in (5).
(13b) R. Riemschneider
Relative Konfigurationsbestimmung. Konfigurationsbezeichnungen von Polyhalocyclohexanen und –cyclohexenen.
Österr. Chem. Ztg. 55, 102 – 107, 161 – 168 (1954); cf Angew. Chem. 65, 543 (1953)
(14) R. Riemschneider
„Herstellung und Reaktionen gemischt halogenierter Cyclohexane und Cyclohexene“ [Mitt. LVII f].
Lecture, given in Colloquium of Farbwerke HOECHST in
February 1965; cf (5) PROJ IX 3,7.
(15) R. Riemschneider, H.-J. Hein
Über die qualitative und quantitative Einwirkung von Zink-Staub auf 60 Polyhalocyclohexane, Beschreibung der Methodik [Mitt. LI]
Ms 1954, based on results of thesis of H.J. Hein; cf PROJ. IX in (5)
(16) R. Riemschneider, S. Singer, H.-J. Hein
Dekahalocyclohexene: C6Cl10 mp 95° – 96°C (I), C6Cl9Br mp 105° – 107°C (II), C6FCl9 mp 95° – 97°C (III). (Mitt. LVII d]
Labreport January 1964, 5 p
(17) C. Weygand, R. Riemschneider, F. Kautzky
Substitution von organisch gebundenem Chlor durch Fluor
mittels SbF3 (SbCl5), HF, CoF2 ecc (Substitution of Cl by F
applying SbF3 (SbCl5), HF, CoF2)
Ms 1941, 10 p; RR responsible for experiments on pages 6 to 10
(18) R.Riemschneider, M.Martin, C.Weygand
Neue Methoden zur Substitution von Chlor (Brom, Jod) durch
Fluor (New methods to substitute Cl,Br,J through F)
Ms 1946, 12 p (unpublished) Continuation of the experiments described in (17): Search for new possibilities to introduce F into Cl-, Br-containing compounds
(19) R. Riemschneider
Halogen-Halogen-Austausch am aromatischen Kern
(Hal-Hal-exchange in aromatic compounds)
Dtsch. Bundes-Patent 947305 vom 21. 11.1954,
Chem.Zbl. 1957, 1799, cf. also lecture from 15 January 1953 at HOECHST, Ffm.
Patent transfered to FARBWERKE HOECHST.
Address for correspondence: rriemschneider@yahoo.de
[1] Reports on experiences of the introduction of fluorine into organic compounds (14, 16-18).
More details about the preparation of the listed poly(hetero)halocyclohexanes and the determination of their constitution and spatial structure in [(5) there PROJ IX] incl. refs of original papers.
[2] Please note that all plates were taken in original from labreports, Mms etc. Summary formulae are corrected in texts.
[3] A.B. BARBOUR, G.R. BARLOW, J.C. TATLOW, J. ROYLANCE, R.F. WORTHINGTON, J. Chem. Soc. [London] 1952, 4695 – 4698; 1954, 4426 – 4429; J. Appl. Chem. 1952, 2, 127 – 130.
[4] Durch Vermittlung von Prof. Dr. Gg. R. Schultze stand Verfasser seit 1951 in persönlichem Kontakt mit den in Fußnote 1 genannten Autoren. Diese hatten seinerzeit entgegenkommender Weise auch den Ausgangsstoff Perfluordicyclohexyl zur Verfügung gestellt, wofür wir ihnen zu Dank verpflichtet sind.
[5] first report on the subject in (9)
*) Unter Tetra-Ölen verstehen wir die bis zur Tetrahalogen-Stufe chlorierten Öle, die nach Abtrennung der kristallisierten C6H8Cl2Br2-Isomeren in reichlicher Menge (90 %) übrigbleiben: Tafeln 5 und 6.
Bei den Chlorierungen tritt unmittelbar nach Überschreitung der „Tetra-Stufe“ Abspaltung von Brom ein, erkennbar an der Braunfärbung des Reaktionsgemisches.
[6] methodic in (15)
[ BWW Society Home Page ]
© 2007 The BWW Society/The Institute for the Advancement of Positive Global Solutions