The Sciences: Chemistry:
Across 7 Decades of Research:
Stereochemistry of Heptites
cis-trans Asymmetry in Heptites[i]
by Dr. Randolph Riemschneider,
Professor Emeritus of Biochemistry and Chemistry
As a result of
stereochemical observations of heptites, the author, a Life BWW Fellow, has
found that cis-trans asymmetry occurs also in this class of compounds. Plate 1. Tables 1
and 2 show possibilities of detection by model experiments on suitable systems.
The author also presents some interesting insights regarding the intrusion of
political factors into scientific research during past decades. -The Editor
In connection with the synthesis of cis-trans asymmetric compounds
[Fig. 1 (1)] the author had discussed, among other things, the stereochemistry
of heptites in lectures of 1941 (10), 1948 and later (2,3,4). According to the
opinion prevalent at the time, this was first considered as an extension of the
pentite problem and later under new aspects, hitherto published only in
lectures. Looking at the heptite formulae reduced to 5 C atoms in Plate 1, we
will find two different types of substitution, namely those which differ by
so-called enantiomeric groups (as in pentites) and those which differ by diastereomeric
groups. In Plate 1, the OH groups are indicated by a line ---, the CH2OH
groups have been left out.

Plate
1: Pentites/Heptites, Type I and II

The numbering 1 to 5 is applicable to pentites where C3
is in the middle, but also for heptites
when the CH2OH terminal groups are left out: middle, actually C4.
Below
the formulae: physical data of well-known heptite isomers; cf. also key to
Plate 3 and Plate 3 itself.
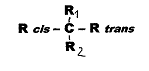 Fig.1:
Fig.1:
cis-trans-asymmetric compounds
We speak of cis-trans asymmetry in the case of
a so-called asymmetric C-atom if two of its four different substitutents
are geometrically isomeric, but symmetric: Fig. 1. In 1955 - 64, it
proved possible to realize several such cases
where geometrical and optical isomerism coincided, summarized in Plate 2.
The consequences resulting from these observations are the following:
While the C atom in the middle is not a so-called asymmetric one in all
representatives of Type I, but it is in all representatives of Type II.
Therefore, Type I a and Type I b each are an analogue of the pentite problem
with all related consequences. The situation is quite different for the representatives
of Type II. These are compounds with 5 so-called asymmetric[ii] C-atoms
of which two each have the "identical position".
Another way to write such isomers which is easier to grasp is the
allocation of the symbols A and B to the diastereomeric substituents. However,
since each diastereomeric group must be shown by two enantiomeric ones, this results
in the symbols +A, -A, +B und –B :
Type l
a b
+A -A +A -A +B
-B +B -B
-A +A +A -A -B
+B +B -B
Meso-forms
Antipode pair A
Meso-forms Antipode pair B
Type II
+A
+B
+A
-B -A -B -A +B
-B -A +B -A +B +A -B +A
Antipode pair C
Antipode pair D Antipode pair E
Antipode pair F
It is evident right away that, in Type I, only the symbols A or B appear, while, in Type
II, there is always a combination of A and B
which then causes asymmetry at the middle C atom.
Some of the simplified experimental plans derived from these model
observations are shown in tables 1 and 2; in these two hitherto unpublished
tables model experiments on suitable systems are to be proposed. Here the
hanger/pendant-principle (“Anhänger/Aufhänger-System”) we have developed will
be useful for implementing the model experiments outlined in these tables and
relating to the heptite problem (6). This is made possible by the experience of
many years gained with the synthesis of the cis-trans
asymmetric compounds.
The dicarboxylic acids of the formula I may be considered as
"hangers". In Table 1, the hanger is formulated with x = 1. Regarding
the synthesis of representatives of x = 0, there is prior experience in
quotation (7, 8); also see Plate 2. Other hangers of interest in connection
with the Type II diamines could be the isolysine synthesised by us in 1961 and
homologues thereof (8a,b). Regarding the synthesis of representatives wherein x
= 0, there is experience set forth in the references (7,8):
R1 R1
HOOC (CH2)x-C-(CH2)x
COOH I H2N-(CH2)x-C-(CH2)x-NH2 II
R2 R2
Experimental trials based on the considerations and model evaluations from the years 1948-51 (2, 3, 4) outlined here
(Plate 1, Table 1 and 2) were to form the basis for the post-doctoral thesis of
a proven co-worker -- at the end of the 60s after the problem of cis-trans isomery had been solved [1955-64
(1): Plate 2]. Regrettably, this habilitation was prevented by the university
reform of 1969 and its consequences even though this work was secured by a
habilitation scholarship.
The co-worker concerned
had recognized the negative consequences resulting form the
"democratisation" of the "Free" University at the time and
left immediately -- as did many of the degraded professors. In the course of
the reform, 800 people were appointed professors by law in August of 1969. They
were referred to as the so-called "discount" or "August" professors,
some of whom "will live off the taxpayer well beyond the year 2000".
This is what Prof. D.A. Lüttringhaus said 1969 to the author and his remaining
co-workers in a telephone call from
In the course of the democratisation of the Free University, the
faculties and all institutes (including their directors) had been “eliminated”
and “split” into ca. “20 Fachbereiche, 5 Zentralinstitute, in viele, viele
wissenschaftliche Einrichtungen und Arbeitsgruppen (work
groups)”.
Operating an
institute as in the past with wide-spread scientific activities was no longer
possible in the work groups who were subject to severe restrictions both
thematically and financially. Major purchases of apparatuses had to be applied
for at least two years in advance. Such applications then had to pass the “zuständige
Direktorium der wissenschaftlichen Einrichtung, die Forschungskommision, den
Zentralinstitutsrat bzw. Fachbereichsrat und später das Abgeordnetenhaus (Parliament
of Berlin)” with the result that co-workers in the meantime left and urgent
work was exported to other universities or even abroad.
Luckily, the author had
found new alternatives for continuing some of his research, partly in
Unfortunately, the planned experimental work described in this essay was
never carried out. The author hopes that a scientist will be found who will
verify by experiments and implement the proposals made in Tables 1 and 2. After
these tables follow plates 2 and 3 and then in APPENDIX the plates 4-6.
Table 1:

For realization the
dotted underlined components would be sufficient.
Table 2:
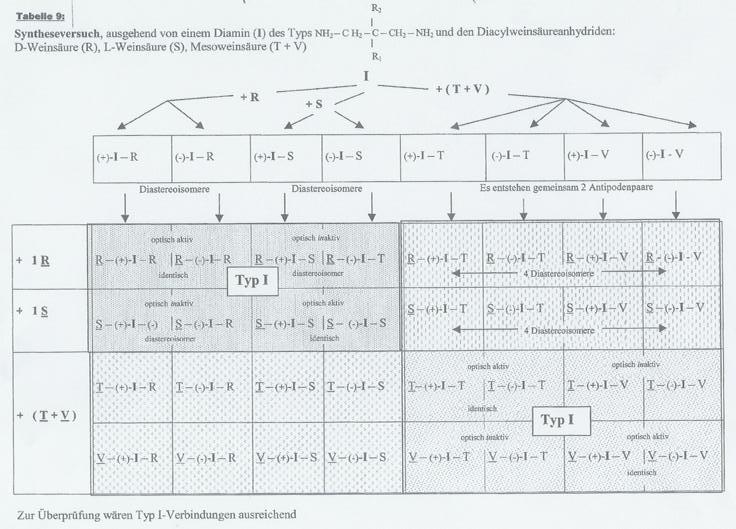
For realization Typ I
component would be sufficient.
Plate 2:
Synthesized cis-trans asymmetric compounds: I,
IV, IX, XII*
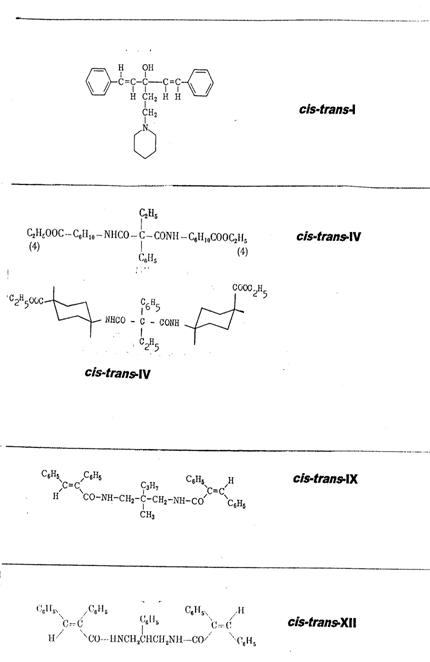
* römische
Nummern nach Referenz (1)
Zur Synthese der
genannten cis-trans-asymmetrischen Verbindungen hatten wir ein sog.
Aufhänger-Anhänger-Prinzip entwickelt (6). Als Aufhänger im Falle von cis-trans-IV
eignete sich die Dicarbonsäure I (x = 0), als Aufhänger im Falle von cis-trans-IX
diente das Diamin II (x = 1).
Plate 3: 16 figures of
HEPTITES,
divided in: 4 mesoforms in
section A) and
6 pairs of antipodes in section B)
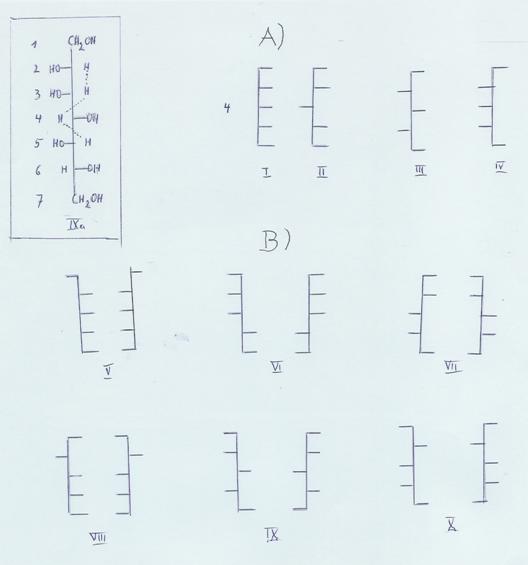
This plate with key, and plate 4-5, are serving to explain: Nomenclature
of the heptite isomeres, their synthesis and properties -- as far as is known.
APPENDIX:
According to Pl 1: 16
stereoisomere Heptites are possible, that is to say 4 mesoforms and 6 pairs of
antipodes -- in the following discussed in Pl. 3 under number I to
X and in the key to Pl 3 where you find data for their synthesis[iii].
The basis for “heptite nomination” is the hexoses survey, the so-called
“Kohlenhydrat-stammbaum der Hexosen”, shown in Plate 4.
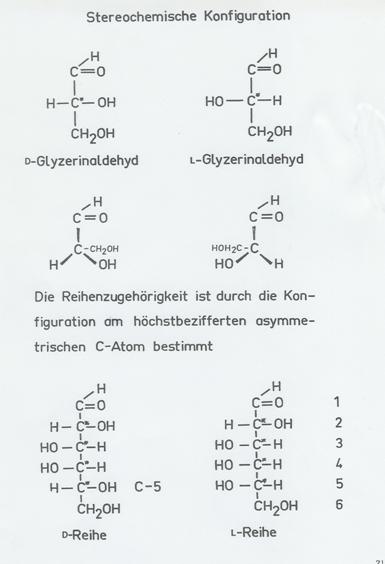
In Plate 5 the terms “D” and “L” are explained[iv]
Key to Plate 3: mesoforms I-IV, pairs of antipodes V-X
I : D-Glycero-D-alloheptit (I).
I entsteht bei
der Cyanhydrinsynthese aus D-Allose nach Reduktion mit RANEY-Nickel über
D-Glycero-D-alloheptono-γ-lacton, Reduktion mit Na-Amalgam zur
D-Glycero-D-alloheptose und deren Reduktion mit RANEY-Ni zum Heptit I.
– Formel der D-Allose in Pl. 4. Synthese nach J W PRATT, N.K.RICHTMYER, J Amer
Chem Soc 77, 6326 (1955).
II:
D-Glycero-D-guloheptit (L-Glycero-L-guloheptit) oder D-Gluco-α-heptit entsteht aus D-Glucoheptulose
durch Reduktion mit Na-Amalgam bzw aus L-Glucoheptulose durch
Druckhydrierung. Synthese nach F L HUMOLLER et al, J.Amer Chem Soc 61, 3372
(1939) bzw W D McLay et al, ebenda 64, 1608 (1942).
III: D-Glycero-L-altroheptit
IV: D-Glycero-L-idoheptit
V: D-Glycero-D-altroheptit
oder D-Glycero-L-alloheptit entsteht bei der
Cyan-hydrinsynthese aus Allose nach Hydrierung mit RANEY-Nickel über
D-Glycero-D-altroheptono-γ-lacton nach Reduktion mit Na-Amalgam,
([α]![]() +0,3°; c: 1,2; H2O) nach
JW PRATT, J.Amer Chem Soc 77, 6326 (1955).
+0,3°; c: 1,2; H2O) nach
JW PRATT, J.Amer Chem Soc 77, 6326 (1955).
VI: D-Glycero-D-taloheptit (Volemit) oder
α-Sedoheptit, in der Natur in der Flechte dermatocarpon miniatum vorkommend: Y.Asahina et al, Ber dtsch chem
Ges 67, 804 (1934). Synhese: Durch Reduktion von D-Altro-heptulose oder Seduheptulose mit Na-Amalgam nach A T MERILL
et al, J Amer Chem Soc 69, 72 (1947)
VII: D-Glycero-L-mannoheptit
VIII: β-Sedoheptit entsteht bei der
Reduktion von D-Altroheptulose
(Seduheptulose) neben
D-Glycero-D-taloheptit mit Na-Amalgam
([α]![]() - 0,75°; c= 4,1; H2O)
nach A T MERILL J Amer Chem Soc 69, 72 (1947)
- 0,75°; c= 4,1; H2O)
nach A T MERILL J Amer Chem Soc 69, 72 (1947)
IX: D-Glycero-L-guloheptit
bzw. D-Gluco-β-heptit entsteht aus D-Gluco-heptulose bei der
Hydrierung an RANEY-Nickel in alkal. Lösung nach Y.Khouvine, Compt. rend. 204,
984(1937) bzw bei der Reduktion mit Na-Amalgam neben D-Glycero-D-guloheptit
([α]![]() + 0,7°; c = 4; H20) nach F L HUMOLLER et al
J Amer Chem Soc 61,
3372 (1939)
+ 0,7°; c = 4; H20) nach F L HUMOLLER et al
J Amer Chem Soc 61,
3372 (1939)
X: D-Glycero-L-glucoheptit
oder D-Gulo-β-heptit ([α]![]() + 2,4°; c=4; H2O) nach TILDEN et al, J Amer Chem Soc 60, 1202 (1938)
+ 2,4°; c=4; H2O) nach TILDEN et al, J Amer Chem Soc 60, 1202 (1938)
Plate 4: “Kohlenhydrat-Stammbaum” (D-Reihe)
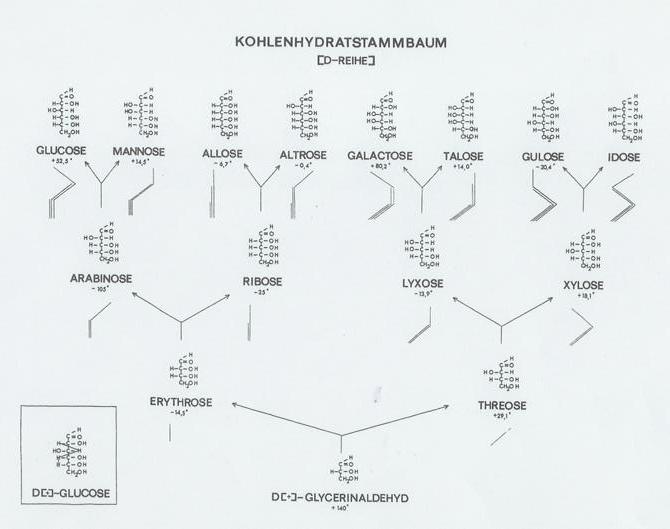
Plate 6: Summary
of the Lecture: “Cancellation of the term pseudoasymmetric
C-atom”, given on 28 Febr 1941 (10)
Der Begriff des pseudoasymmetrischen C-Atomes wurde zu
einer Zeit geschaffen, in der das asymmetrische C-Atom praktisch allein zur Erklärung der optischen Aktivität
einer Verbindung herangezogen wurde und man die Anwesenheit eines
asymmetrischen C-Atomes als alleinige Ursache der optischen Aktivität ansah.
Das pseudoasymmetrisehe C-Atom -- nach der Definition von Werner mit vier
verschiedenen Substituenten besetzt, von denen zwei stofflich und strukturell
gleich und entgegengesetzt asymmetrisch
gebaut sind -- kann selbst nie Träger der optischen Aktivität sein, weil es
immer das Zentrum eines symmetrischen Moleküls bildet.
Die gleichen
Verhältnisse liegen bei der von Baeyer aufgefundenen relativen Asymmetrie vor, die auf cyclische Verbindungen
beschränkt ist und sich von der Pseudoasymmetrie nur dadurch unterscheidet, daß
sich im Molelkül keine asymmetrischen C-Atome befinden und die relativ
asymmetrischen C-Atome in einem Molekül immer von der Anwesenheit eines
anderen__relativ asymmetrischen C-Atoms abhängig sind.
Da die optische
Aktivität einer Verbindung eigentlich nur von der Asymmetrie des Gesamtmoleküls
abhängig ist, ist das asymmetrische C-Atom nur ein Spezialfall[vi]
der Molekular-asymmetrie, bei welcher man die Asymmetrie des Gesamtmoleküls auf
ein bestimmtes C-Atom (oder auf bestimmte C-Atome) zurückführen kann.
Unter diesem Gesichtspunkt sind die Begriffe “pseudoasymmetrisches
C-Atom” und “relative Asymmetrie” überflüssig. Zur Erklärung der optischen
Aktivität sind sie nicht zu verwenden, da sie ausnahmslos in symmetrischen
Molekülen vorkommen. Es besteht kein Grund, für diese, sich durch keinerlei
besonderen Eigenschaften auszeichnenden Fälle, eine eigene Bezeichnung zu
wählen.
(1) R. Riemschneider cis-trans asymmetrical compounds, 2006, http://www.bwwsociety.org/journal/html/stereochem.htm
(2) R.
Riemschneider
Stereochemische Betrachtungen über die theoretisch möglichen
Heptite und
ähnliche Verbindungen (Modellversuche) sowie daraus abgeleitete Basis für experimentelle Arbeiten,
Mitt. Physiolog.-Chem. Inst Berlin, Dez 1948, 18 S., 4 Tafeln;
Vortrag, gehalten im Dez. 48 im Physiolog.-Chem. Institut der
Universität Berlin
(3) R. Riemschneider
“Stereochemische Betrachtung an
Heptiten (Modellversuche) und an «Achse-Ring»-Molekülaggregaten”
Öffentliche Antrittsvorlesung an der Freien
Universität Berlin im
Rahmen des Verfahrens der Umhabilitierung
im Fach Organische Chemie, gehalten am 5.5.1950 im großen
Hörsaal des Zoologischen
Instituts der FU Berlin (Diskussionsleiter: Prof. Dr. G. Schenck und Prof. Dr.
A. Dinghas); zum Inhalt vgl. Tab 1 u 2
sowie Zitat (4)
(4) R.
Riemschneider (Vortragender), L. Ottaviani
“Theoretisch mögliche Heptite
unter dem Aspekt der verschiedenen Isomieriefälle und Literaturübersicht über die bisher bekannten Heptite
und ihre Konstitution (Konfiguration) ”,
Vortrag I vor leitenden Wissenschaftlern der MONTECATINI-Werke in Mailand, Via
Turati, am 20.4.1951, während meines einmonatigen Aufenthaltes in Mailand auf Einladung der Montecatini-Werke (in italienischer
Sprache).
Die hier genannten
Ausarbeitungen über Heptite und analoge Verbindungen (vgl. auch Tabellen 1 und 2) bildeten die Grundlage für eine geplante
Habilitationsarbeit; diese sollte nach Realisierung von Fällen der “cis-trans-Asymetrie” durchgeführt
werden. Leider kam es infolge der “Universitätsreform im August 1969 nicht zur
Durchführung derartiger
Untersuchungen. Das erwähnte Habilitationsthema war von der Deutschen
Forschungsgemeinschaft für meinen langjährigen Mitarbeiter Dr. E.B. Grabitz
bewilligt worden; wegen der zu erwartenden Universitätsreform ist dieser
vorzeitig nach Italien emigriert. Eine Übertragung der Bewilligung auf einen
anderen promovierten, geeigneten Mitarbeiter entfiel jedoch, da auch diese das
neue Universitätsgesetz als wissenschafts-vernichtend voraussahen.
The texts of the
lectures (2-4) remained unpublished at the time at the suggestion of professors
Dr. Richard Kuhn and Dr. A. Lüttringhaus, because they contained substantial
references to the further work of the author. Plate 1 and the Tables 1 and 2
were shown as slides in the lectures.
(5) R.
Riemschneider (Vortragender), O. Göhring, H. Arnold, E. Hausmann, W. Stuck
“Wege zur Synthese von cis-trans-asymmetrischen Verbindungen: «Aufhänger-Anhänger-Prinzip»”
Vortrag II vor leitenden Wissenschaftlern der MONTECATINI-Werke in Mailand, Via
Turati, am 27.4.1951 (in italienischer Sprache),
Manuskript Januar 1951, 29 S.
Beispiele
für cis-trans-isomere Anhänger und Beschreibung der Synthese von zeitweise in Betracht
gezogenen Aufhängern z.B.: aus Dihydroxypivalinsäure und a,a-p-Xylylen-diglycin (charakterisiert
als a,a-p-Xylylen-diglycin-dimethylester-Dihydrochlorid
vom Schmp. 220°C);
vgl. auch
Vorträge und Exposé aus den Jahren 1943 und 1948 (6).
(6) R.
Riemschneider
“Re-reading – 66 years chemistry”:
26 PROJECTS over 1400 references (in preparation)
hier betreffend: PROJECT II 3: cis-trans-Asymmetrie
(7a) R. Riemschneider, D. Kirstein
cis-trans-Asymmetrie, Mitt. X:
Ethyl-phenyl-malonsäure-a
,ß-bis-(4-carboxy-cyclohexyl-amide),
Z.Naturforschg.
17 b, 522-524 (1962) und
Ethyl-phenyl-malonsäure-monochlorid,
Mh.Chem.
94, 419-421 (1963)
(7b) R. Riemschneider, H. Kampfer
Zur cis-trans-Asymmetrie,
Mitt. XI:
Optische
Aktivität von cis-trans-1,3-Bis-[a-phenyI-
cinnamoyl-amino]-2-methyl-2-n-propyl-propan,
Liebigs
Ann.Chem. 665, 35-42 (1963); vgl. auch Z.Naturforschg. 16b, 704 (1961)
(7c)
R. Riemschneider, A. Rook
Zur
cis-trans-Asymmetrie, Mitt. VII:
Nachweis
der optischen Aktivität des 1-cis-3-trans-Bis-
[a-phenylcinnamoylamino]-2-phenyl-propans,
Mh.Chem.
92, 1227-1234 (1961)
(8a)
R.Riemschneider, K.Brendel, K.Preuß,
Synthese von Isolysin und Homologer,
Mh.Chem. 92, 1235-1241 (1961)
(8b) R. Riemschneider, A. Rook
Zur
cis-trans-Asymmetrie, Mitt. VI:
Mono-
und Diacyclierung des 1,3-Diamino-propans mit stereoisomeren Säurechloriden,
Mh.Chem.
92, 1197-1200 (1961)
(9) R. Riemschneider
Zur
cis-trans-Asymmetrie, Mitt. I:
„Molekulare Asymmetrie als Oberbegriff für
alle asymmetrisch gebauten
organischen Verbindungen incl. des sogenannten »asymmetrischen
C-Atoms[v]«. Energetische Betrachtungsweise",
Vortragsmanuskript vom März 1948; Basis auch für spätere Vorträge,
gehalten 1.) auf dem IUPAC-Kongreß in Zürich am 26.7.1955, 2.) im Mathematischen Institut der Freien
Universität Berlin am 10.10.1955 (Diskussionsleiter Prof. Dr. A. Dinghas) und
3.) im Mathematischen Institut
der Technischen Universität Berlin im Dez 1955 (Diskussionsleiter: Prof. Dr.
Mohr)
(10) R. Riemschneider
“Cancellation of the term pseudoasymmetric
C-atom”
Ms 1941, 34 p
Lecture given on 28 Febr 1948 in chem
Colloquium, Dept of Org Chem, Univ Hamburg (chair: Prof Dr H H Schlubach)
Summary of lecture in Pl 6, published in (6),
there in PROJ II 9,4.
Correspondence:
e-Mail: rriemschneider@yahoo.de
[i] Continuation of
the observations made under quotation (1), including earlier references to the
topic "cis-trans- asymmetry",
e.g. Comm. V-XII. Comm. I cited under (9).
[ii] The common term
"asymmetric C atom" is actually misleading when taking a closer look
at the tetrahedron model forming the basis of the term: It is not the C atom
located in the middle of the tetrahedron that is asymmetric; asymmetry is
caused by the four different substituents
located on the corners of the tetrahedron model. –Concerning the term
“pseudoasymmetric C-atom”, see Plate 6
[iii] Über die von uns inzwischen
synthetisierten, noch fehlenden Isomeren wird an anderer Stelle berichtet
werden
[iv] Pl 4 and 5 taken
from R.Riemschneider, „Material für biochemische Einführungsvorlesungen“ 1969 (1.Auflage), S. 20, 21; Druck: W.Hilke
KG, Berlin 30.
[v] cf. footnote 2.
[ BWW Society Home Page ]
© 2007 The Bibliotheque: World Wide Society